額溫槍(紅外線測溫儀)針對量測人體額溫基準設計,使用非常簡單、方便。1秒可準確測溫,無鐳射點,免除對眼睛之潛在傷害,不需接觸人體皮膚,避免交叉感染,一鍵測溫,排查流感。
1、中國
依據(jù)NMPA 2017年8月發(fā)布的《醫(yī)療器械分類目錄》,07-03-04體溫測量設備,產(chǎn)品描述:用紅外方法測量臨床測量患者體溫,通常用于測量患者耳道、額頭部位溫度;產(chǎn)品為II類醫(yī)療器械,由制造商所屬的省級食品藥品監(jiān)督管理局審查、批準。
產(chǎn)品認證流程
1、依據(jù)產(chǎn)品《技術要求》委托CNAS授權(quán)的各省醫(yī)療器械檢測所進行產(chǎn)品的測試;
2、準備注冊文件,結(jié)合各公司實際生產(chǎn)情況和型式試驗報告編寫;額溫計產(chǎn)品已列入豁免臨床的產(chǎn)品目錄(最新編號353),但需要提供精確度驗證報告(依據(jù)GB/T 21417-1:2008);
3、注冊文件齊全后向省藥監(jiān)局申報,省藥監(jiān)局受理;
4、藥監(jiān)局審理注冊文件的同步,派出審核官對制造商進行現(xiàn)場質(zhì)量體系考核;
5、制造商收到注冊證書后準備生產(chǎn)許可證申請資料,一般向市市場監(jiān)督管理局申請頒發(fā)生產(chǎn)許可證書;
其他
資料清單:《醫(yī)療器械注冊申請表》、證明性文件、醫(yī)療器械安全有效基本要求清單、綜述資料、研究資料(重點:需軟件驗證和壽命周期驗證)、生產(chǎn)制造信息、臨床評價資料、產(chǎn)品風險分析資料、產(chǎn)品技術要求、產(chǎn)品注冊檢驗報告、產(chǎn)品說明書及最小銷售單元的標簽樣稿、符合性聲明、申辦人身份證證明資料、質(zhì)量體系考核申請文件等;
時間:型檢3個月(需要EMC試驗)+注冊審批4個月(含現(xiàn)場質(zhì)量體系考核)+生產(chǎn)許可證審批1個月=8個月(正常審批狀態(tài));
費用:各省情況不一,一般各省直屬檢測中心正常型檢不收費,注冊費目前大部分省市有收費,可檢索各省市藥監(jiān)局注冊收費情況。
2、美國
依據(jù)美國FDA分類:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPCD/classification.cfm
對關鍵詞“thermometer” 進行查詢
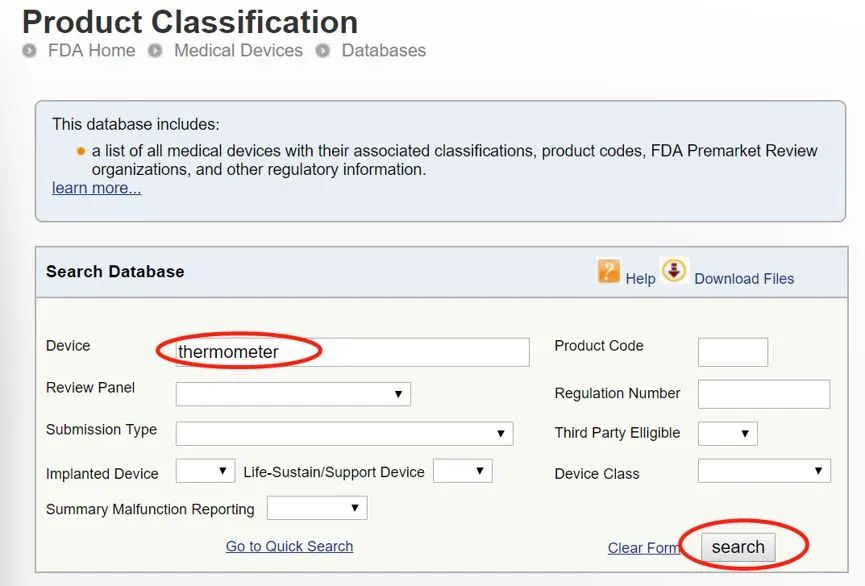
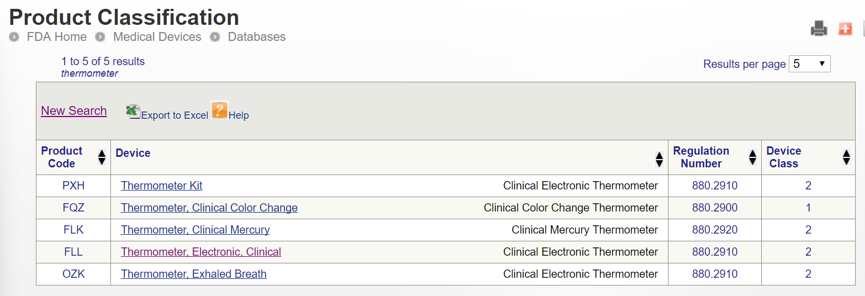
選擇合適的代碼:
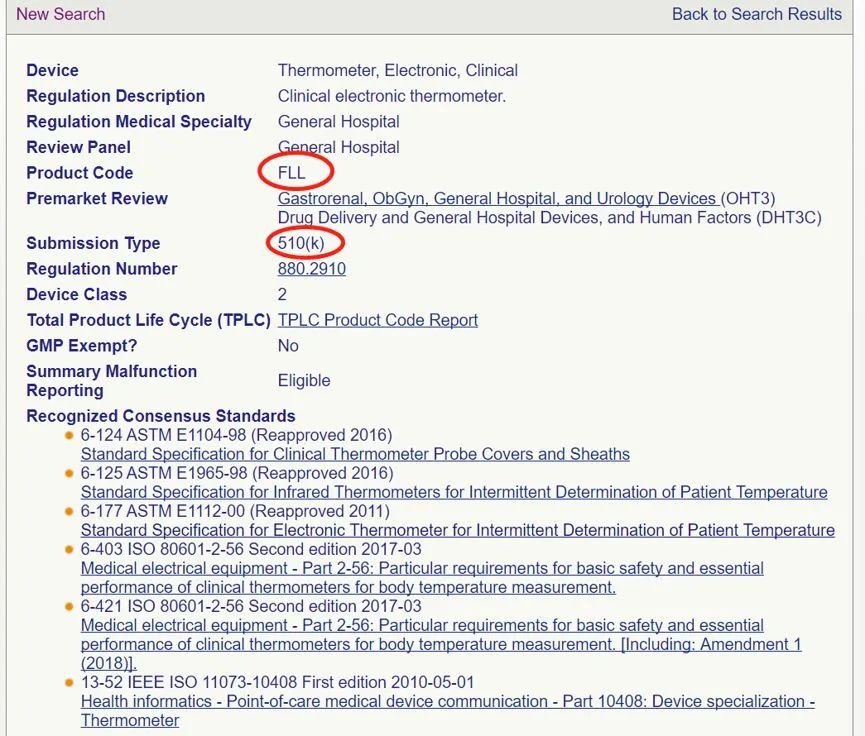
依據(jù)FDA指南編寫510k報告,提交美國FDA審批。
關鍵技術點
1、產(chǎn)品的性能測試包括:
IEC60601-1:2005+A1:2012,IEC60601-1-2:2014,IEC60601-1-11:2015,ISO80601-2-56:2017/ ASTM_E1965-98_2016 ;
外殼塑料件及顯示屏等需要滿足ISO10993-5:2009,ISO10993-10:2010生物學測試;
2、依據(jù)ASTM_E1965-98_2016專標驗證需要進行產(chǎn)品精確度驗證,采集相關臨床數(shù)據(jù)信息與水銀溫度計,已獲批510k的電子體溫計、額溫計等進行數(shù)據(jù)對比統(tǒng)計分析;
3、費用及周期:美國FDA 510k審核費,2020年正常官方費用:$11,594,小規(guī)模企業(yè)可申請優(yōu)惠:$2,899;正常周期,啟動項目至審批10個月左右;
3、歐盟
依據(jù)Regulation(EU)2017/745 on medical devices即MDR;依據(jù)Annex VIII分類規(guī)則10,IIa,需要公告參與審核體系ISO13485:2016及CE技術文件。
關鍵技術點
1、產(chǎn)品的性能測試包括:
IEC60601-1:2005+A1:2012,IEC60601-1-2:2014,IEC60601-1-11:2015,ISO80601-2-56:2017 ;
外殼塑料件及顯示屏等需要滿足ISO10993-5:2009,ISO10993-10:2010生物學測試;
2、依據(jù)ISO80601-2-56:2017專標驗證需要進行產(chǎn)品精確度驗證,采集相關臨床數(shù)據(jù)信息與水銀溫度計,已通過CE認證的電子體溫計、額溫計等進行數(shù)據(jù)對比統(tǒng)計分析;
3、費用及周期:由于歐盟采用的是委托具備資質(zhì)的第三方公告機構(gòu)監(jiān)管方式,審核并頒發(fā)證書,相關費用以NB機構(gòu)報出的為準;鑒于目前已獲得資質(zhì)的10家機構(gòu)還未全面進行業(yè)務受理,周期不得而知,依據(jù)MDD的經(jīng)驗,預計12-15個月左右;
4、韓國
當前韓國疫情蔓延趨勢嚴重,詢問韓國KFDA注冊的較多,重點介紹一下韓國注冊的相關要求:
韓國醫(yī)療器械準入的法規(guī)門檻,基本分類為I、II、III、IV類,持證為韓國公司(License holder),且韓代職責較重,如:快速通關、快速到門的服務、倉庫管理,包括韓國保址部所有監(jiān)管事宜而且在海關業(yè)務的應急時間等全鏈條內(nèi)容,接受KGMP定期評審等。
KFDA的等級標準
●等級I:非接觸人體的或無潛在危險性的產(chǎn)品;
●等級II:對人體具有一定的危險性但對人體生命的危險及造成的影響和危險性比較低的產(chǎn)品;
●等級III:一定時間內(nèi)插入人體使用或潛在的危險性比較高的產(chǎn)品;
●等級IV:永久的移植到人體內(nèi)或直接接觸到心臟、中樞神經(jīng)神經(jīng)等而使用的產(chǎn)品;
相關流程
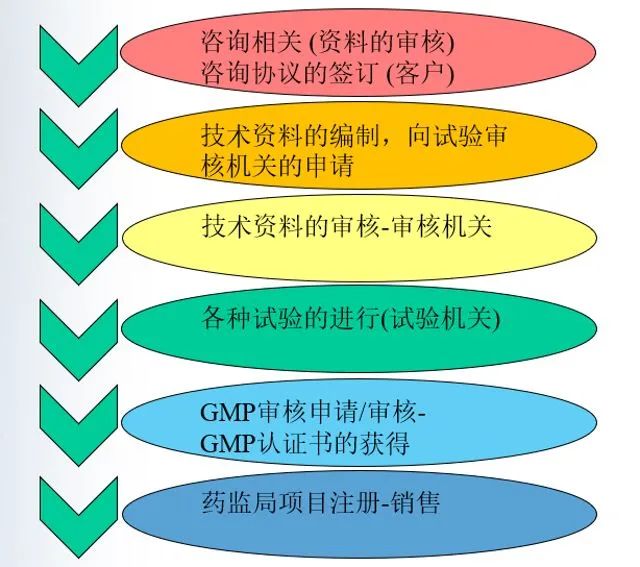
韓國注冊相關內(nèi)容
申請KGMP證書和接受現(xiàn)場審核;
對于II類產(chǎn)品一般是委托授權(quán)的第三方審核員完成審核(但筆者前期服務的案例中,也都是韓國保址部官員),若為III IV類產(chǎn)品則由韓國保址部(相當于中國藥監(jiān)局)自行審核,并獲得KGMP證書;
寄送樣品到韓國MFDS授權(quán)的實驗室進行韓標的測試;
由韓代向MFDS提交技術文件(包括TCF、檢測報告、KGMP證書等),同時還需要向韓國保址部繳納申請費,后續(xù)由該機構(gòu)進行注冊文件的審核,最終獲得批準,后續(xù)方可入市。額溫槍屬于韓國II類產(chǎn)品,預計周期6-9個月。
證書信息參考



 服務熱線
400-800-6106
服務熱線
400-800-6106




